| (5 révisions intermédiaires par 2 utilisateurs non affichées) | |||
| Ligne 10 : | Ligne 10 : | ||
|Tags=bicarbonate, vinaigre, fusée, gravité, chimie | |Tags=bicarbonate, vinaigre, fusée, gravité, chimie | ||
}} | }} | ||
| − | {{Introduction}} | + | {{Introduction |
| + | |Introduction=Un protocole illustré est aussi disponible dans l'onglet <nowiki>''</nowiki>Fichiers<nowiki>''</nowiki> juste en dessous, n'hésite pas à le télécharger ! | ||
| + | }} | ||
{{Materials | {{Materials | ||
|ItemList={{ItemList | |ItemList={{ItemList | ||
| + | |Item=Bouteille plastique | ||
| + | }}{{ItemList | ||
|Item=Bouteille plastique | |Item=Bouteille plastique | ||
}}{{ItemList | }}{{ItemList | ||
| Ligne 37 : | Ligne 41 : | ||
}}{{Prerequisites | }}{{Prerequisites | ||
|Prerequisites=Pourquoi les fusées sont-elles pointues | |Prerequisites=Pourquoi les fusées sont-elles pointues | ||
| + | }} | ||
| + | |Tuto_Attachments={{Tuto Attachments | ||
| + | |Attachment=Fus_e_Bicarbonate-Vinaigre_Protocole_Illustr_-_Fabrication_d_une_fus_e_bica-vinaigre.pdf | ||
}} | }} | ||
}} | }} | ||
| Ligne 107 : | Ligne 114 : | ||
| − | C'est maintenant à toi de jouer pour | + | C'est maintenant à toi de jouer pour réfléchir, faire des tests et résoudre ces soucis afin de réussir un décollage parfait :) |
|Step_Picture_00=Fus_e_Bicarbonate-Vinaigre_Mise_en_place_du_d_collage_4.jpg | |Step_Picture_00=Fus_e_Bicarbonate-Vinaigre_Mise_en_place_du_d_collage_4.jpg | ||
|Step_Picture_00_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":-30,"top":-49,"width":8192,"height":6144,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.08,"scaleY":0.08,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/a/a2/Fus_e_Bicarbonate-Vinaigre_Mise_en_place_du_d_collage_4.jpg","filters":[]}],"height":449.7803806734993,"width":600} | |Step_Picture_00_annotation={"version":"3.5.0","objects":[{"type":"image","version":"3.5.0","originX":"left","originY":"top","left":-30,"top":-49,"width":8192,"height":6144,"fill":"rgb(0,0,0)","stroke":null,"strokeWidth":0,"strokeDashArray":null,"strokeLineCap":"butt","strokeDashOffset":0,"strokeLineJoin":"miter","strokeMiterLimit":4,"scaleX":0.08,"scaleY":0.08,"angle":0,"flipX":false,"flipY":false,"opacity":1,"shadow":null,"visible":true,"clipTo":null,"backgroundColor":"","fillRule":"nonzero","paintFirst":"fill","globalCompositeOperation":"source-over","transformMatrix":null,"skewX":0,"skewY":0,"crossOrigin":"","cropX":0,"cropY":0,"src":"https://www.wikidebrouillard.org/images/a/a2/Fus_e_Bicarbonate-Vinaigre_Mise_en_place_du_d_collage_4.jpg","filters":[]}],"height":449.7803806734993,"width":600} | ||
| Ligne 159 : | Ligne 166 : | ||
[[Pourquoi les fusées sont-elles pointues]] | [[Pourquoi les fusées sont-elles pointues]] | ||
| + | |||
| + | [[Fusée à eau]] | ||
| + | |||
| + | [[Fusée à air]] | ||
[[Acidification des océans]] | [[Acidification des océans]] | ||
| Ligne 176 : | Ligne 187 : | ||
}} | }} | ||
{{Tuto Status | {{Tuto Status | ||
| − | |Complete= | + | |Complete=Published |
}} | }} | ||
Version actuelle datée du 5 juillet 2024 à 10:18
Introduction
- Matériel et outils
- Expériences pré-requises
- Fichiers
Étape 1 - Tester la réaction bicarbonate-vinaigre
Dans un pot en verre verse une demi-cuillère de bicarbonate de soude, ajoute un fond de vinaigre blanc puis observe.
Que vois-tu ?
Qu'entends-tu ?
Étape 2 - Dessiner le prototype
Essaye de dessiner le prototype de ta fusée (tu peux t'aider du matériel listé ci- dessus si besoin).
Pense bien au remplissage du carburant, à la stabilité, l'aérodynamisme, au poids, à la solidité etc...
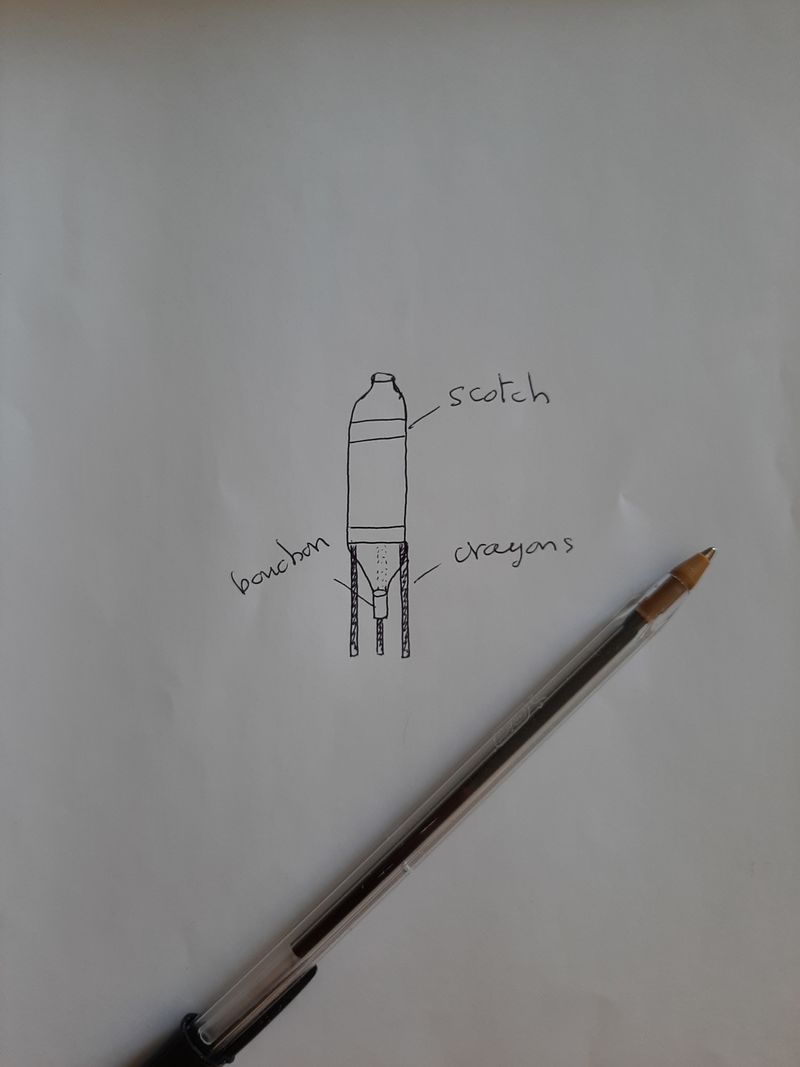
Étape 3 - Construction
Construis ta fusée selon le modèle que tu as dessiné. Demande à un adulte pour la découpe des bouteilles.
Utilise le scotch pour accrocher les crayons en bas et la bouteille découpée en haut.
Teste également l'étanchéité de ton bouchon en liège (il doit rentrer parfaitement dans le goulot de la bouteille mais sans avoir à trop forcer non plus).
N'oublie pas de décorer ta fusée comme bon te semble !
Étape 4 - Préparation du carburant
Pour faciliter l'ajout du bicarbonate de soude réalise des baluchons avec le papier absorbant et une ficelle.
Étale une cuillère de bicarbonate sur le coté de la feuille de papier absorbant, plie la en deux et roule la entièrement.
Ensuite, ferme avec un bout de ficelle (environ 20cm) le coté ouvert en faisant un double nœud.
Une fois fermé, vérifie qu'il rentre bien par le goulot de la bouteille et qu'il ne fuit pas.
Étape 5 - Décollage
Rends toi à l'extérieur avec le matériel nécessaire, dans un espace dégagé, accompagné d'un adulte, pour tester ta fusée. Vérifie la stabilité de la zone de lancement (aide toi d'une morceau de carton si nécessaire).
Verse environ 5 centimètres de vinaigre dans la bouteille principale puis insère le baluchon de bicarbonate sans le faire tomber dans la bouteille !
Enfonce légèrement le bouchon de liège tout en coinçant bien la ficelle du baluchon. Il doit pendre comme sur la photo.
Enfin, retourne rapidement ta fusée, secoue et pose la puis recule d'au moins 5 mètres. La réaction va démarrer et la fusée devrait se mettre à gonfler légèrement avant de décoller !
Sois patient la réaction prend du temps :)
Étape 6 - Améliorations
Il est possible que la fusée ne décolle pas dès le premier coup. Ce n'est pas grave !
Demande à un adulte de la récupérer avec précaution et de retirer le bouchon en orientant la bouteille vers un endroit ou il n'y a personne ! (attention la pression peut être encore forte à l'intérieur).
Il est aussi possible que la fusée ait décollé de biais, ou bien pas très haut. De nombreux problèmes peuvent rentrer en jeu (bouchon qui fuit, fusée trop lourde, bouchon trop enfoncé, fusée pas stable...).
C'est maintenant à toi de jouer pour réfléchir, faire des tests et résoudre ces soucis afin de réussir un décollage parfait :)
Comment ça marche ?
Observations : que voit-on ?
Lorsqu'on retourne la fusée, la bouteille se met à gonfler jusqu'à faire sauter le bouchon et se propulser dans les airs.
Mise en garde : qu'est-ce qui pourrait faire rater l'expérience ?
Un bouchon de liège non étanche ou trop enfoncé, une fusée trop lourde ou peu stable au décollage, du vinaigre ou du bicarbonate trop vieux, des quantités trop faibles...
Explications
Lorsqu'on retourne la fusée, le vinaigre est absorbé par le papier essuie tout et rencontre le bicarbonate. Des bulles se forment la bouteille se met à gonfler. Ces bulles sont produites par la réaction chimique entre le vinaigre et le bicarbonate.
Les bulles sont en réalité du gaz, le dioxyde de carbone (ou CO2) . Durant la réaction, sa quantité augmente de plus en plus dans la bouteille faisant monter la pression. Lorsque la pression est trop forte le bouchon saute et le gaz se libère brusquement, propulsant la fusée dans les airs.
Plus d'explications
Le mélange de bicarbonate et de vinaigre provoque une réaction acido-basique suivie d'une réaction de décomposition.
Le vinaigre contient de l'acide éthanoïque (CH3COOH), et le bicarbonate de sodium (aussi appelé hydrogénocarbonate de sodium, NaHCO3) est une base.
Mélangés, le bicarbonate et le vinaigre réagissent et forment de l'acide carbonique (H2CO3) très instable, qui se décompose aussitôt en formant de l'eau et du dioxyde de carbone (CO2) .
Le dioxyde de carbone produit sous forme gazeuse se dégage dans la bouteille. Comme le bouchon fixé sur la bouteille rend l'ensemble étanche, le gaz ne peut pas s'en échapper. La pression augmente dans la bouteille et devient trop forte pour être contenue par le bouchon.
Voici le détail des réactions en jeu :
Le bicarbonate de sodium se dissocie au contact de l'eau en ions sodium (Na+) et bicarbonate (HCO3−) :
NaHCO3 → Na+ + HCO3−.
Le vinaigre contient une part d' acide éthanoïque (environ 5 %), composé d'ions oxonium (H3O+) et éthanoate (CH3COO−) :
CH3COOH <–> H3O+ + CH3COO−.
Les ions oxonium réagissent avec les ions bicarbonate et forment de l’acide carbonique : (H2CO3) : H3O+ + HCO3- → H2CO3 + H2O
Instable, l’acide carbonique se dissocie immédiatement en formant du dioxyde de carbone (CO2), et de l'eau (H2O) :
H2CO3 → H2O + CO2
La réaction complète se résume ainsi :
NaHCO3 + CH3COOH → CO2 + H2O + CH3COONa
Le CO2 une fois formé est soluble dans l'eau. Toutefois lorsque l'eau arrive à saturation de CO2, l'excédent commence à former des bulles qui finissent par remonter. C'est l'effervescence. (C'est la même chose que pour le sel de cuisine. Le sel de cuisine est soluble dans l'eau. Mais quand on arrive à saturation, le sel en excès reste sous forme solide).
Applications : dans la vie de tous les jours
Les gaz sous pression entrent en jeu dans un grand nombre d'équipements et de technologies. La vapeur d'eau a longtemps été un moyen de propulsion pour les locomotives et les bateaux, et participe encore à la propulsion des navires à turbines nucléaires. Les fusées et les avions à réaction se déplacent grâce à l'expulsion de gaz à haute pression.
Les tireuses de boissons gazeuses fonctionnent au dioxyde de carbone (CO2).
Les bouteilles de plongée contiennent de l'air comprimé à une pression d'environ 200 bars.
La plus importante production de CO2 par l'homme est involontaire : elle est essentiellement due à la combustion d'énergies fossiles (gaz naturel, charbon et pétrole), qui en libère des quantités phénoménales dans l'atmosphère. Ce rejet massif de CO2 par les activités humaines contribue au réchauffement climatique par augmentation de l'effet de serre, et provoque notamment un phénomène d'acidification des océans.
Vous aimerez aussi
Gonfler un ballon sans souffler
Pourquoi les fusées sont-elles pointues
Éléments pédagogiques
Objectifs pédagogiques
- Mettre en évidence simplement le gaz produit par une réaction chimique.
- Illustrer les notions de volume et de pression à travers un exemple concret.
- Emettre des hypothèses et réaliser des essais comparatifs pour améliorer un prototype.
Pistes pour animer l'expérience
Il intéressant de démarrer cette animation par l'activité ''dessine moi une fusée'' où les enfants ont une minute pour dessiner une fusée. Cela permet de partir de ce qu'ils connaissent des fusées afin de les guider vers les éléments nécessaires à sa construction, les notions mis en jeu, les risques...
Prévoir un temps suffisamment long pour les tests afin de permettre une réelle réflexion et amélioration des prototypes.
Sources et ressources
De nombreux articles de l'encyclopédie en ligne Universalis abordent le dioxyde de carbone, ses propriétés chimiques, ses applications et ses impacts environnementaux :
http://www.universalis.fr/encyclopedie/carbonique-dioxyde-de-carbone/
Dernière modification 5/07/2024 par user:Animateur LRSY.
Published