| Ligne 2 : | Ligne 2 : | ||
|Main_Picture=G_n_rateur_d_hydrog_ne_G_nerarateur_HHO.jpg | |Main_Picture=G_n_rateur_d_hydrog_ne_G_nerarateur_HHO.jpg | ||
|Licences=Attribution (CC-BY) | |Licences=Attribution (CC-BY) | ||
| − | |Description= | + | |Description=Obtenir de l'hydrogène par électrolyse. La récupérer et créer de mini explosions ou une flamme extrêmement chaude si l'on en produit suffisamment et que l'on dispose d'un brûleur adapté. |
| − | |||
| − | |||
|Disciplines scientifiques=Chemistry, Electricity, Physics | |Disciplines scientifiques=Chemistry, Electricity, Physics | ||
|Difficulty=Expert | |Difficulty=Expert | ||
| Ligne 12 : | Ligne 10 : | ||
}} | }} | ||
{{Introduction | {{Introduction | ||
| − | |Introduction=A l' heure de la transition Energétique nous parlons beaucoup de l'hydrogène. Or l'hydrogène n'existe pas à l'état pure sur terre. Pour en obtenir on doit l'extraire de molécules en contenant déjà. Notre industrie l'extrait principalement de ressources fossiles (95% de la production mondiale) notamment par le craquage du méthane (CH4) en le mettant dans de l'eau chauffée à près de 1000°C ce qui demande beaucoup d'énergie et qui en plus rejette beaucoup de carbonne (C). Une autre façon beaucoup moins répendu | + | |Introduction=A l' heure de la transition Energétique nous parlons beaucoup de l'hydrogène. Or l'hydrogène n'existe pas à l'état pure sur terre. Pour en obtenir on doit l'extraire de molécules en contenant déjà. Notre industrie l'extrait principalement de ressources fossiles (95% de la production mondiale) notamment par le craquage du méthane (CH4) en le mettant dans de l'eau chauffée à près de 1000°C ce qui demande beaucoup d'énergie et qui en plus rejette beaucoup de carbonne (C). Une autre façon beaucoup moins répendu, très cher mais efficace et '''potentiellement''' moins polluante consiste à aller le chercher dans l'eau (H²O) par électrolyse. '''Potentiellement moins polluante''' car tout dépend de la provenance de l'électricité qui sert à l'électrolyse... Il existe d'autres métodes pour avoir de l'hydrogène mais pour le moment totalement anecdotique. |
| Ligne 18 : | Ligne 16 : | ||
| − | + | Lorsque l'on parle de l'hydrogène pour les transports il faut comprendre que dans la grande majorité des cas le moteur ne brule pas directement l'hydrogène mais qu'il s'agit de moteur électrique dont l'électricité provient d'une pile à combustible elle même nourit à l'hydrogène. | |
}} | }} | ||
{{Materials}} | {{Materials}} | ||
| Ligne 31 : | Ligne 29 : | ||
| − | '''<u>L'alimentation électrique:</u>''' fournit l'électricité en courant continu (dc) | + | '''<u>L'alimentation électrique:</u>''' fournit l'électricité en courant continu (dc). au système |
| − | <u>'''Le multimètre :'''</u> Il permet de contrôler la puissance du système, On l'utilise en mode ampèremètre il se branche en série à la sortie de l'alimentation. Si l'on dispose d'une pince Ampèremétrique aucun branchement n'est nécessaire | + | <u>'''Le multimètre :'''</u> Il permet de contrôler la puissance du système, On l'utilise en mode ampèremètre il se branche en série à la sortie de l'alimentation. Si l'on dispose d'une pince Ampèremétrique aucun branchement n'est nécessaire, celà fonctionne par magnétisme. |
'''<u>L'Electrolyseur</u>''' | '''<u>L'Electrolyseur</u>''' | ||
| − | Il est étanche, c'est là que sont produit | + | Il est étanche, c'est là que sont produit ces gazs.On y trouve : |
| Ligne 58 : | Ligne 56 : | ||
{{Tuto Step | {{Tuto Step | ||
|Step_Title=Fabrication Alimentation Electrique | |Step_Title=Fabrication Alimentation Electrique | ||
| − | |Step_Content= | + | |Step_Content=Ici j'utiliserais le 12Vdc qui me délivre maximum 17A. |
| − | |||
| − | |||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
|Step_Title=Fabrication Electrode - méthode 1 | |Step_Title=Fabrication Electrode - méthode 1 | ||
| − | |Step_Content=Cette méthode donne une électrode plus petite, nécessite moins de matériel et est plus rapide à la fabrication. | + | |Step_Content=Cette méthode donne une électrode plus petite, nécessite moins de matériel et est plus rapide à la fabrication. Néanmoins elle est plus fastidieuse à fabriquer car les électrodes sont plus proches et les risques de court circuit sont important, l'entretien y est compliqué et elle est plus fragile. |
| + | |||
| − | https://www.youtube.com/watch?v=Uz0REdjpJtI | + | Je ne vais pas develloper cette métode. Simplement quelques photos et ce lien vidéo:https://www.youtube.com/watch?v=Uz0REdjpJtI |
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
|Step_Title=Fabrication Electrode - méthode 2 | |Step_Title=Fabrication Electrode - méthode 2 | ||
| − | |Step_Content= | + | |Step_Content=Plus longue à la fabrication et& plus imposante elle est plus adaptée à une utilisation pédagogique car plus visuelle et solide. |
| − | |||
| − | |||
| − | |||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
| − | |Step_Title=Assemblage de l'électrolyseur | + | |Step_Title=Fabrication et Assemblage de l'électrolyseur |
| − | |Step_Content= | + | |Step_Content=Ici je décris la fabrication pour les électrodes méthode 2. |
| − | + | 1 grand pot de confiture, tuyau 30cm, de la colle, 2 pièces de plastiques isolantes, 4 écrous/rondelles, fils électrique, tefelon. | |
| − | + | '''Perçage''' | |
| − | - | + | -Percer 2 trous (10mm) pour le passage des tiges filetées (6mm) de l'électrode. Les trous doivent être plus grands car le couvercle est en métal, si les tiges le touche elles seront en court circuit. |
| + | -Percer un trou au diamètre de votre tuyau. | ||
| − | |||
| + | '''Assemblage''' | ||
| − | - | + | - Mettre de la colle sur le dessus de la pièce qui maintient l'entraxe de vos électrodes. elles servira notamment d'étanchéité. |
| − | - | + | - Glisser vos électrodes dans les trous du couvercle, veiller à ce qu'elles ne le touchent pas |
| − | - | + | - placer vos 2 pièces isolantes telles des rondelles sur les tiges filetés, rondelle/écrou, serrez. '''Vos électrodes sont maintenant solidaire du couvercle.''' |
| − | - | + | - Glisser le tuyau dans le trou prévus, il dépasse de 1 cm sous le couvercle, coller dessus dessous. |
| − | |||
| + | '''Finition''' | ||
| − | + | - Connection des fils électrique : Sur les tiges filetées dépassant du couvercle, rondelle/ Fil/ rondelle/écrou, serrez. | |
| + | - Etanchéité améliorée : placer du tefelon (sens horaire) sur le filetage du pot. | ||
| − | - | + | - Placer vos électrodes dans le pot, ça passe ? |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
}} | }} | ||
{{Tuto Step | {{Tuto Step | ||
|Step_Title=Fabrication du bulleur | |Step_Title=Fabrication du bulleur | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
}} | }} | ||
{{Notes}} | {{Notes}} | ||
Version du 8 mai 2020 à 17:15
Sommaire
Introduction
A l' heure de la transition Energétique nous parlons beaucoup de l'hydrogène. Or l'hydrogène n'existe pas à l'état pure sur terre. Pour en obtenir on doit l'extraire de molécules en contenant déjà. Notre industrie l'extrait principalement de ressources fossiles (95% de la production mondiale) notamment par le craquage du méthane (CH4) en le mettant dans de l'eau chauffée à près de 1000°C ce qui demande beaucoup d'énergie et qui en plus rejette beaucoup de carbonne (C). Une autre façon beaucoup moins répendu, très cher mais efficace et potentiellement moins polluante consiste à aller le chercher dans l'eau (H²O) par électrolyse. Potentiellement moins polluante car tout dépend de la provenance de l'électricité qui sert à l'électrolyse... Il existe d'autres métodes pour avoir de l'hydrogène mais pour le moment totalement anecdotique.
Le rendement et le coût de la production d'hydrogène n'est franchement pas un avantage donc il est judicieux de se poser la question de à quoi va til servir ? Mettre de l'hydrogène partout n'est souvent pas le premier choix intelligent à faire.
Étape 1 - Définition des termes
Une Electrolyse de l'eau pour obtenir de l'hydrogène ça marche comment ?
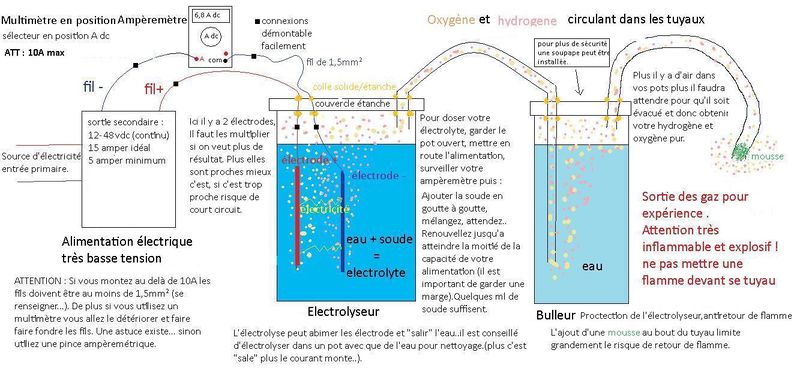
On fait passer de l’électricité dans de l’eau (électrolyseur), cela a pour effet de casser la molécule d’eau H²0 pour obtenir du dihydrogène H² d’un coté et du dioxygène O² de l’autre. Il faut ensuite pouvoir récupérer ces gazs en sécurité (bulleur).
Pour contôler cette électricité on utilise un multimètre.
L'alimentation électrique: fournit l'électricité en courant continu (dc). au système
Le multimètre : Il permet de contrôler la puissance du système, On l'utilise en mode ampèremètre il se branche en série à la sortie de l'alimentation. Si l'on dispose d'une pince Ampèremétrique aucun branchement n'est nécessaire, celà fonctionne par magnétisme.
L'Electrolyseur
Il est étanche, c'est là que sont produit ces gazs.On y trouve :
- Les électrodes sont les moceaux de métal que l'on trempe dans l'électrolyte et par ou sortira l'électricité. il y a une électrode + (anode) et une - (cathode) . Il faut les multiplier pour obtenir un bon résultat. Les + et les - ne doivent pas se toucher.
- L'électrolyte est de l'eau (si possible distillée) dans laquelle on ajoute une matière qui facilitera la circulation du courant. Ici de la soude. Eviter le sel cela produit un gaz toxique.
Puis ces gazs passe via un tuyau vers le bulleur.
Le bulleur
C'est un élément de sécurité pour le matériel et les personnes. C'est un récipient étanche remplis d'eau qui reçoit les gazs venus de l'électrolyseur. Ils remontent dans l'eau et ressortent via un autre tuyau pour leurs utilisation. En cas de retour de flamme c'est le bulleur qui encaisse et empêche la flamme d'aller jusqu'à l'électrolyseur.
Étape 2 - Fabrication Alimentation Electrique
Ici j'utiliserais le 12Vdc qui me délivre maximum 17A.
Étape 3 - Fabrication Electrode - méthode 1
Cette méthode donne une électrode plus petite, nécessite moins de matériel et est plus rapide à la fabrication. Néanmoins elle est plus fastidieuse à fabriquer car les électrodes sont plus proches et les risques de court circuit sont important, l'entretien y est compliqué et elle est plus fragile.
Je ne vais pas develloper cette métode. Simplement quelques photos et ce lien vidéo:https://www.youtube.com/watch?v=Uz0REdjpJtI
Étape 4 - Fabrication Electrode - méthode 2
Plus longue à la fabrication et& plus imposante elle est plus adaptée à une utilisation pédagogique car plus visuelle et solide.
Étape 5 - Fabrication et Assemblage de l'électrolyseur
Ici je décris la fabrication pour les électrodes méthode 2.
1 grand pot de confiture, tuyau 30cm, de la colle, 2 pièces de plastiques isolantes, 4 écrous/rondelles, fils électrique, tefelon.
Perçage
-Percer 2 trous (10mm) pour le passage des tiges filetées (6mm) de l'électrode. Les trous doivent être plus grands car le couvercle est en métal, si les tiges le touche elles seront en court circuit.
-Percer un trou au diamètre de votre tuyau.
Assemblage
- Mettre de la colle sur le dessus de la pièce qui maintient l'entraxe de vos électrodes. elles servira notamment d'étanchéité.
- Glisser vos électrodes dans les trous du couvercle, veiller à ce qu'elles ne le touchent pas
- placer vos 2 pièces isolantes telles des rondelles sur les tiges filetés, rondelle/écrou, serrez. Vos électrodes sont maintenant solidaire du couvercle.
- Glisser le tuyau dans le trou prévus, il dépasse de 1 cm sous le couvercle, coller dessus dessous.
Finition
- Connection des fils électrique : Sur les tiges filetées dépassant du couvercle, rondelle/ Fil/ rondelle/écrou, serrez.
- Etanchéité améliorée : placer du tefelon (sens horaire) sur le filetage du pot.
- Placer vos électrodes dans le pot, ça passe ?
Étape 6 - Fabrication du bulleur
Dernière modification 11/03/2023 par user:Antonydbzh.
Draft