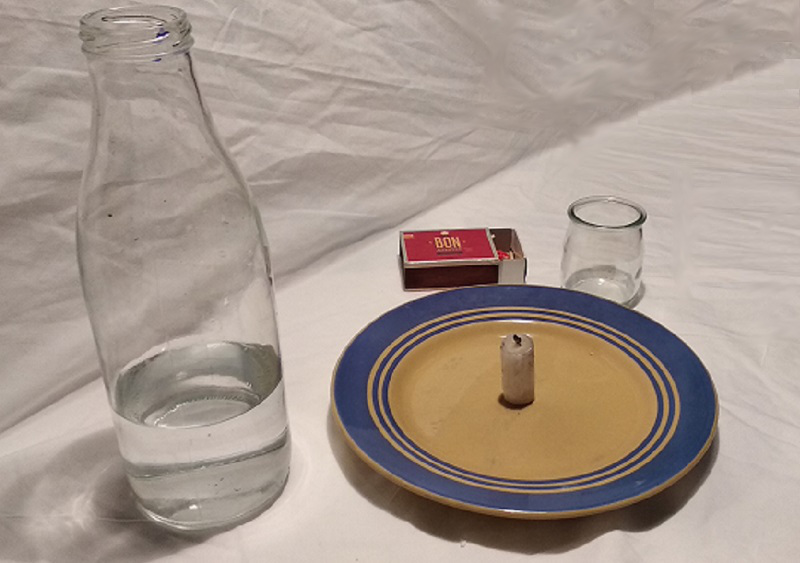Introduction
Que se passe-t-il quand tu éteins une chandelle entourée d'eau en l'enfermant dans un verre ?
La réponse, avec cette expérience sur les propriétés de l'air chaud et de l'air froid qui prolonge celle du ballon dans une bouteille.
- Matériel et outils
Lors de pique-niques on utilise des assiettes jetables en mousse de polystyrène, en carton ou en matière plastique.
Par métonymie, l'assiette peut désigner son contenu (exemple : une assiette de bouillon).Étape 1 - Réunir le matériel
- une ou plusieurs bougies ( bougies chauffe plat par exemple)
- une assiette
- une boîte d'allumettes ou un briquet
- un ou plusieurs bocaux en verre
- De l'eau
Étape 2 - Préparer l'expérience
Verse un peu d'eau au fond de l'assiette (on peut mettre du colorant dans l'eau pour que l'expérience soit plus visible).
Étape 3 - Réaliser l'expérience
Mets la bougie au milieu de l'assiette. Puis allume là !
Couvre la bougie avec le verre puis observe ce qu'il se passe !
Comment ça marche ?
Observations : que voit-on ?
La flamme s'éteint rapidement puis l'eau monte dans le verre.
Mise en garde : qu'est-ce qui pourrait faire rater l'expérience ?
Pour que l'expérience fonctionne au mieux, il faut réussir à obtenir une différence de température importante entre le début et la fin de l'expérience. Donc il est souhaitable de partir avec du matériel et de l'eau froids. Le temps pendant lequel la bougie brûle est aussi important : si elle s'éteint trop vite elle ne peut pas chauffer beaucoup l'ensemble. Ainsi il est plus efficace d'utiliser un contenant haut (mais pas trop volumineux) dans lequel il y a un volume d'air important (qui contient du dioxygène) au desssus de la bougie. Par exemple une bouteille en verre type jus de fruit et une bougie coupée de façon à ce qu'elle mesure la moitié de la hauteur de la bouteille fonctionne très bien.
Dernier point. Quand on refait l'expérience plusieurs fois d'affilée, il faut trouver un moyen de renouveler l'air dans le bocal ou la bouteille. En effet le dioxygène qui était contenu dedans a été consommé et donc la bougie va s'éteindre très vite si il n'est pas renouvelé.
Explications
Lorsque tu couvre la bougie avec le verre il se passe deux choses :
- D'une part, la combustion nécessite du dioxygène (O2) et produit du dioxyde de carbone (CO2). Lorsque la quantité de dioxygène présente dans le verre devient trop faible alors la flamme s'éteint.
- D'autre part, la flamme de la bougie produit de la chaleur qui va chauffer l'air présent dans le verre. L'air en chauffant se dilate. C'est à dire que pour la même quantité d'air, cet air prend plus de place. On peut d'ailleurs constater cette dilation, car lorsque l'on pose le bocal sur la bougie, un bulle d'air s'échappe.
Lorsque la flamme s'éteint (du fait du manque d'oxygène) l'air refroidit. A l'inverse de la dilatation , en se refroidissant, l'air se rétracte, c'est à dire qu'il prend moins de place. L'eau va alors être aspirer dans le verre occupant la place ainsi libérée.
Plus d'explications
Ce phénomène fait intervenir la loi des gaz parfaits, PV=nRT, avec :
- P : la pression (Pa),
- V : le volume du gaz (m3),
- n : la quantité de matière (mol),
- R : la constante universelle des gaz parfaits (≈ 8,314 J·K-1·mol-1),
- T : la température absolue (K).
Dans notre cas, la quantité de mol (n) et la constante (R), ne varient pas.
Dans un premier temps la température augmente, la production de gaz fait varier son volume mais vu que le verre garde le même volume, la pression augmente un petit peu.
Puis lorsque la flamme s’éteint la température diminue et la rétraction de l'air devenu froid, fait diminuer le volume d'air et sous l'effet de la pression, l'eau est aspirée dans le verre et une fois l'eau dans le verre la pression redevient normal.
Applications : dans la vie de tous les jours
L'air chauffé dans la cocotte-minute est contenue sous pression lorsqu'elle est fermée et une fois le sifflet ouvert la pression diminue ce qui nous permet de l'ouvrir.
Vous aimerez aussi
L'expérience Ballon dans une bouteille issue du même parcours : Dilatation et rétraction de l'air
Éléments pédagogiques
Objectifs pédagogiques
- Illustrer le phénomène de dilatation et de rétractation de l'air dû à la chaleur.
Pistes pour animer l'expérience
- Cette expérience est basée sur l'observation d'un phénomène assez spectaculaire. Joue la carte du mystère et du suspens pour attirer l'attention de ton public !
- Demande de l'aide à un adulte pour l'utilisation des allumettes et éloigne autour de toi tous les objets qui peuvent s'enflammer facilement.
Sources et ressources
Dernière modification 26/07/2021 par user:Nathanaël Latour.
Published